今天推送的文章是发表在BiochemicalandBiophysicalResearchCommunications上的“Structure-guidedrationaldesignoftheGeobacillusthermoglucosidasiusferuloylesteraseGthFAEtoimproveitsthermostability”,通讯作者是福建师范大学生命科学学院吴允昆教授。
先前的研究已于2019年从GeobacillusthermoglucosidasiusDSM2542T中分离纯化并鉴定了一种嗜热碱性阿魏酸酯酶GthFAE。GthFAE具有较高的稳定性和最适pH,在50℃、pH为8.5时活性最好。在40-60℃条件下,FAE在8h内仍能保持80%以上的酶活力,在碱性环境中120min仍能保持90%以上的酶活力。此外,该酶可在大肠杆菌中异源表达,经离子交换柱层析或亲和层析纯化,对阿魏酸甲酯和阿魏酸乙酯的比活分别为161.7±6.94U/mg和19.02±2.36U/mg。因此,GthFAE具有较好的热稳定性、耐碱性、pH稳定性、较好的酶活性以及适合于规模化生产等特点,是一种潜在的工业阿魏酸酯酶,特别是在造纸工业中具有广阔的应用前景。细菌FAEs只有少数结构被解决,因此,为了进一步增强其热稳定性优势,有必要对GthFAE进行结晶学研究,为GthFAE工程提供理论基础和初步信息。对活性中心周围的残基进行了定点突变,观察到了热稳定性的提高,并在电子分析中解释了可能的分子机制。
SDS-PAGE和凝胶过滤层析分析表明,28kDa重组GthFAE纯化至均一结晶状态,酶在溶液中以二聚体形式存在。该结构的分辨率为1.9Å,属于P1211空间群,晶胞常数为a=46.04Å,b=87.41Å,c=69.46Å,α=γ=90°,β=95.97°。表1总结了衍射和精化统计数据。每个不对称单元包含两个相同的分子,通过PDBePISA服务器计算,它们在Cα原子上共享0.589Å的RMSD。这两个单体没有表现出广泛的相互接触,这表明与溶液中的状态不同,这两个单体是由于晶体堆积而不是二聚化。

表1
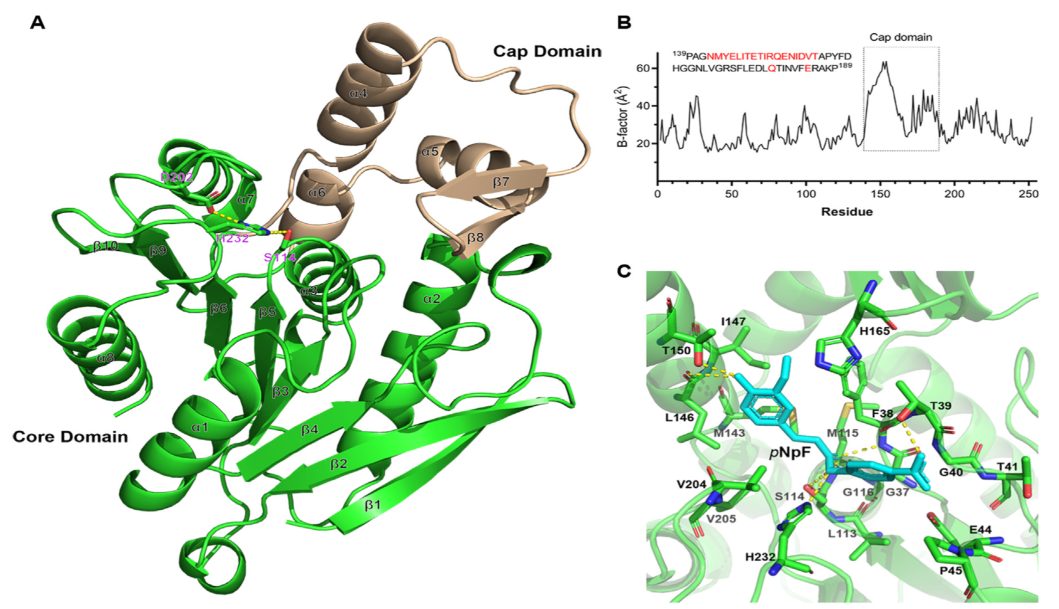
图1
帽子结构域和催化囊结构的变化与酶底物偏好、催化活性和热稳定性的差异密切相关。虽然以前的研究很少选择催化口袋上的残基来提高热稳定性,但已经有一种成功的活性中心稳定策略被用于通过位点饱和突变来提高假丝酵母脂肪酶1的动力学热稳定性。与野生型相比,一个多位点突变体(F344I/F434Y/F133Y/F121Y)在60℃时的半衰期延长了40倍,Tm活性增加了12.7℃,活性没有下降。考虑到B因子排在前20位的GthFAE残基都位于离催化口袋不远的帽区(图1B),因此提高其热稳定性的尝试集中在它上面。
为了找到GthFAE的催化口袋,进行了分子对接研究,将底物pNPF对接到GthFAE的疏水空腔中,从300次运行中得到了12个不同的构象簇。Rank1簇包含的构象比其他簇多得多,更重要的是,它包含了结合能最低的簇,其结合能为-8.18kcal/mol。在构象中,组成催化口袋的pNPF5Å内有19个残基,但消除了高度保守的残基,其中只有11个被认为是诱变的候选者(图1C)。根据保守性分析的多序列比对,天冬酰胺在与GthFAE中的Thr41序列同源物的第41位残基对应的位点出现的频率要高得多。丙氨酸的情况与Ile147相似。此外,Met143、Leu146、Ile147和Thr150被用FoldX通过PositionScan选择用于计算机突变,因为它们的B因子排名最高。除Met143外,有3个突变体ΔΔG0,应为有益突变体。值得注意的是,Thr150是一个“热点”,因为其19个突变体中有14个的ΔΔG值为负值。Thr41位于核心区β3和α1之间的环上,Leu146、Ile147和Thr150均位于帽状区面向催化口袋的α4上。残留物均暴露在表面。因此,作者对Thr41、Leu146、Ile147和Thr150进行了诱变,重点研究了Thr150,构建了6个突变体:T41N、L146A、I147A、T150Y、T150R和T150I。
对热稳定性的测量可以确定该设计是否适用于GthFAE。用底物pNPF测定了野生型及其突变体的酶活性,评价突变体的标准包括其对热稳定性和活性的影响。与以往报道不同的是,GthFAE的最适温度为60℃,而不是50℃。L146A、I147A和T150I没有进一步研究,因为I147A和T150I的粗酶相对活性低于野生型的50%,而L146A的粗酶相对活性为122%,Tm值低于野生型。
如图2所示,T41N、T150Y和T150R突变体的Tm值分别比野生型(73.6℃)高2.6℃、3.9℃和3.6℃,其中T150Y最高77.5℃。由于T150Y和T150R的Tm值相似,相差0.3℃的微小差距,考虑到T150R的更高活性,作者仅将T150R与T41N组合形成突变体T41N/T150R,Tm达到80℃,增加了6.4℃。不幸的是,与Tm上升相反,所有突变体的酶活性都降低了,与60℃的相对活性相比,T41N最接近野生型,其次是T41N/T150R。
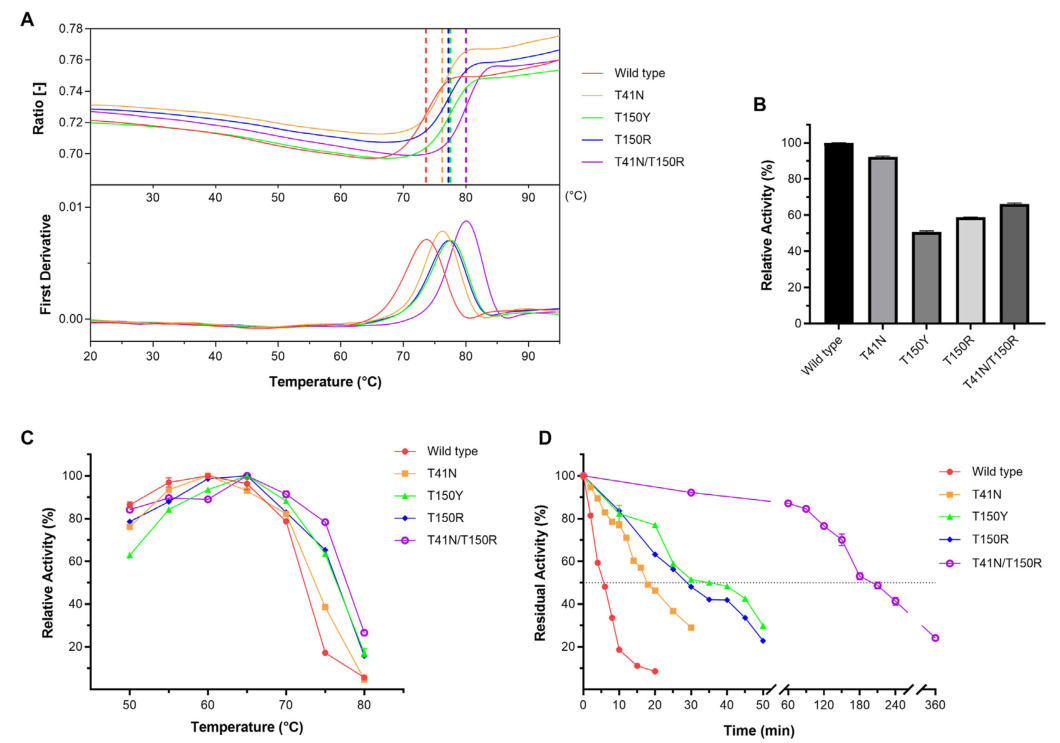
图2
在不同温度下测量野生型和GthFAE突变体的酶活性,以研究最佳温度的变化。T41N的最佳温度为60℃,这与我们研究中的重组GthFAE一致。在75℃时,当野生型仅保留17%的活性时,它们仍然表现出超过60%的高活性,特别是T41N/T150R,保留了78%。所有的酶在很宽的温度范围内都表现出很高的活性,野生型在50-65℃,三个单位点突变体在55-70℃,组合突变体在50-70℃时的活性超过80%。GthFAE及其突变体的残留活性是在70℃时测量的。野生型t1/2约为5.7分钟,而T41N、T150Y和T150R分别约为18分钟、35分钟和29分钟,是野生型t1/2的3.1-6.2倍。T41N/T150R孵3h后保留其初始活性的50%以上,t1/2为201min,为野生型的35倍。加热2h后仅牺牲不到25%的活性,6h的剩余活性为24%。因此,诱变可以极大地提高热稳定性,无论是单一的还是组合的,T41N/T150R在高温下的表现都非常出色。
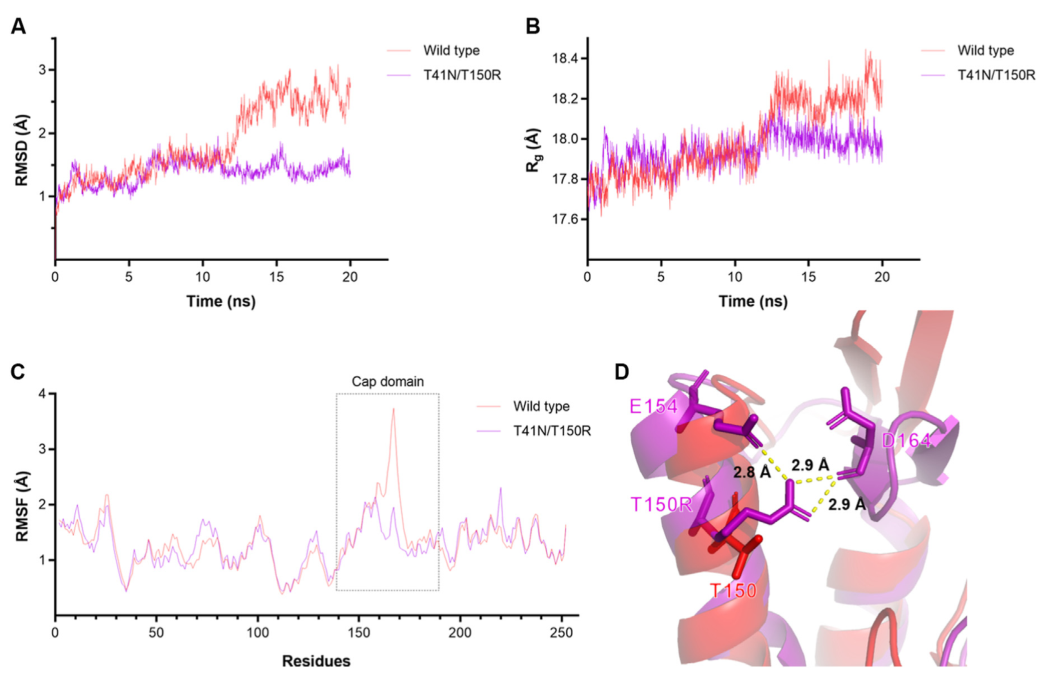
图3
作者认为本研究中组合突变体的热稳定性提高与T150和周围天冬氨酸或谷氨酸之间引入盐桥,以及T41N提高蛋白质表面亲水活性的综合结果。为了研究热稳定性性能的分子基础,进行分子动力学模拟以检查GthFAE在突变前后的结构变化。RMSD和回转半径(Rg)的分析均表明T41N/T150R的结构比野生型更稳定,骨架Cα原子的RMSD值表征系统的稳定性,Rg代表蛋白质的紧密度(图3A和B)。RMSD图显示T41N/T150R系统在模拟开始后很快达到平衡,而系统在野生型达到平衡之前波动了15ns。当系统处于平衡状态时,突变体的Rg值略低可以证明它与野生型相比具有更接近的构象,这可能是由于T41N亲水作用所致。在最后2ns期间,两个系统处于平衡状态,残基的平均RMSF值表明突变体的稳定性可能是由于帽域的灵活性降低(图3C)。然而,残基41周围没有显著变化,如图3D所示,T150R通过将盐桥引入E154和D164的区域来稳定帽域,这与作者的推测一致。因此,MD模拟的结果可以解释为什么突变对热稳定性起作用。
整理:李岚雪
文章信息:
PMID:35219099
DOI:10.1016/
-
JBL V150NC自适应降噪,轻松俘获你的耳朵!
2024-12-25 -
美国瑰宝 Legacy Expression 发烧落地箱:双八寸单元的威力
2026-01-17 -
巅峰对决!苹果三星新款智能手表对比评测:哪款更值得入手?
2025-03-21 -
酒吧专业音响介绍
2024-11-22