免疫失调可表现为自身免疫性疾病、自身炎症、过敏或淋巴增生。
在先天性免疫缺陷(inbornerrorofimmunity,IEI)患者中,通常被称为非感染性并发症。免疫失调在所有的IEI中都有报道,并且可能是IEI的初始表现。
在常见的可变免疫缺陷(commonvariableimmunedeficiency,CVID)中,免疫失调而非感染是死亡的主要原因。免疫失调也见于更常见的多基因免疫介导的炎症性疾病(IMIDs)。
衰老相关B细胞
使用T-bet缺失B细胞狼疮小鼠模型,2002年科学家证实T-bet的B细胞在自身免疫性疾病中的重要性。同年,报告了自身免疫性血细胞减少与CVID中CD21lowB细胞增加相关。
在2011年的blood上,两个不同研究组(文献1,2)发表文章正式描述了衰老相关B细胞(AGE-ASSOCIATEDB,ABCs)。
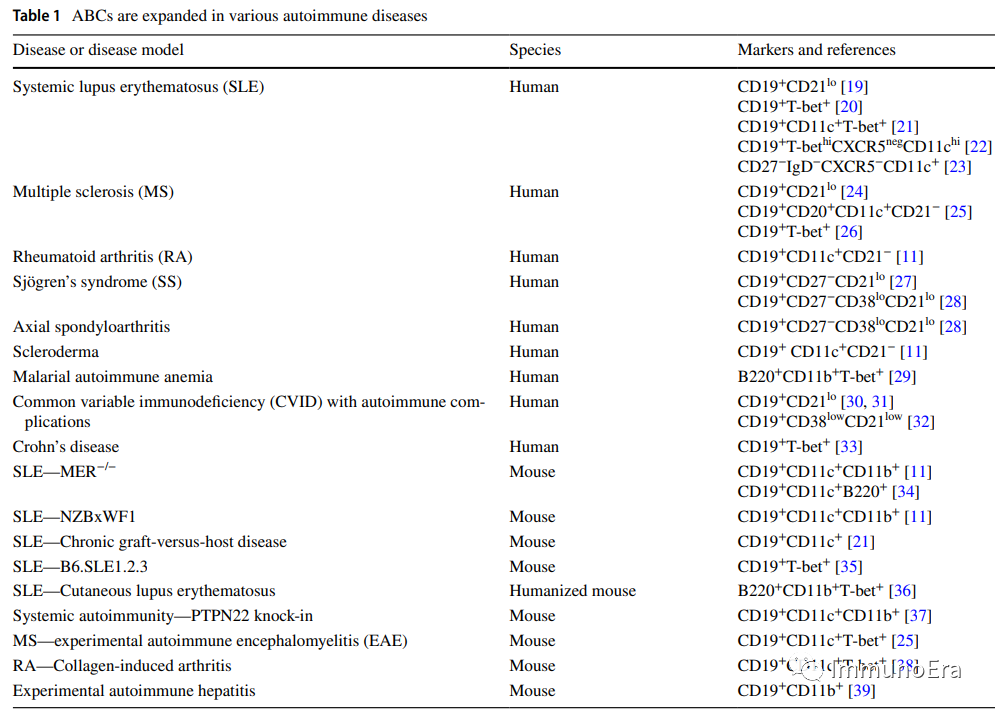
不同的研究使用的标志物有差异,现在比较认可的ABCs的标志物组合为:T-bet+,CD21low,CD11c+,CD11b+。
CellularandMolecularLifeSciences(2022)
炎症末端器官中衰老相关B细胞的扩张和迁移
炎症末端器官中与衰老相关B细胞的扩张和迁移周期。表达CXCR3的TH1细胞通过CD40L/CD40和分泌IL-21和IFN-g在抗原呈递过程中与B细胞相互作用。这导致了ABC的诱导,其特征是CD21表达降低,转录因子T-bet和趋化因子受体CXCR3表达上调。反过来,ABC分泌IFN-g,进一步促进TH1细胞分化。炎症组织中的细胞,包括ABCs,表达趋化因子CXCL9、CXCL10和CXCL11,它们与受体CXCR3结合,进一步促进ABCs和表达CXCR3的TH1细胞向靶组织迁移。ABC和TH1细胞共同刺激靶组织,循环再次开始。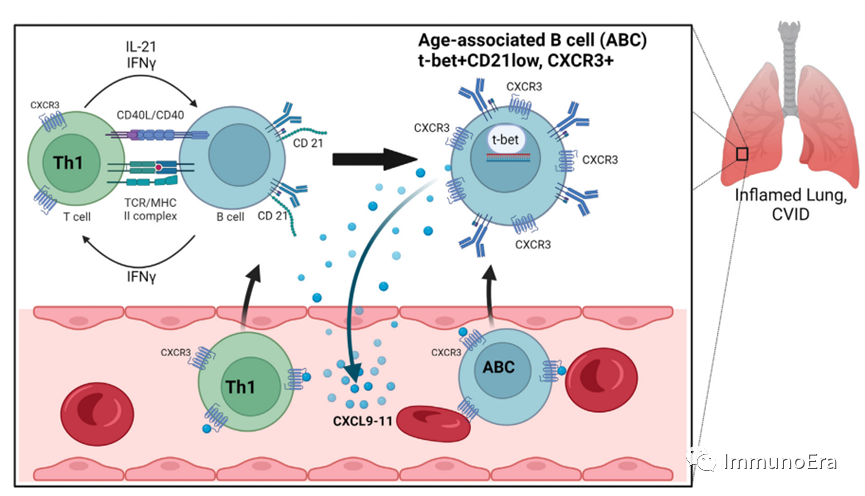
衰老相关T细胞
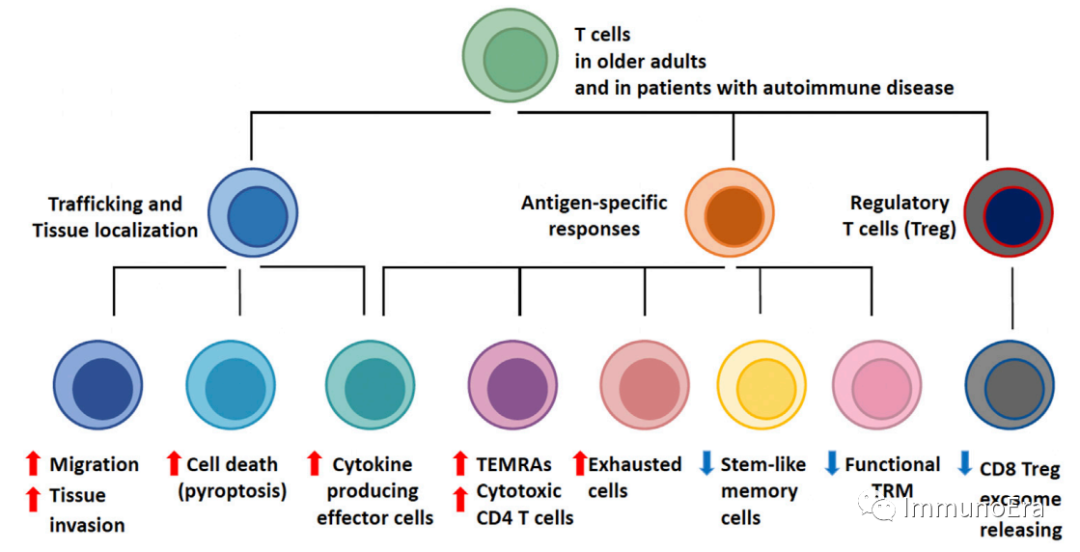
衰老同样会影响T细胞,产生T细胞衰老相关表型(T-cellaging-associatedphenotypes,TASP)。
T细胞衰老相关表型
T细胞的老化会导致T细胞池组成发生深刻变化。T细胞老化的主要决定因素包括在面对持续磨损时新T细胞生成的减少,以及急性和慢性抗原暴露、渐进性分化和稳态增殖所造成的应力。随着幼稚T细胞数量的减少,表型和功能定义的T细胞亚群的谱扩大。功能适应发生在三个主要领域:随着年龄的增长,T细胞变得更具移动性和组织侵袭性;随着年龄的增长,T细胞分化为细胞因子过度产生并具有细胞毒性功能的效应群体;随着年龄的增长,调节性T细胞(Treg)恶化,允许产生无节制的效应反应。老年T细胞池中T细胞表型的组装倾向于更低的特异性和更多的炎症免疫。T细胞衰老相关表型(TASP)在晚发性自身免疫性疾病患者中富集,并与致病性组织炎症有关,确定T细胞衰老过程是自我耐受性丧失的一个危险因素。
调节性T细胞异常
去除自身反应性B细胞有两个检查点:中枢检查点和外周检查点。
调节性T细胞是外周检查点的核心。
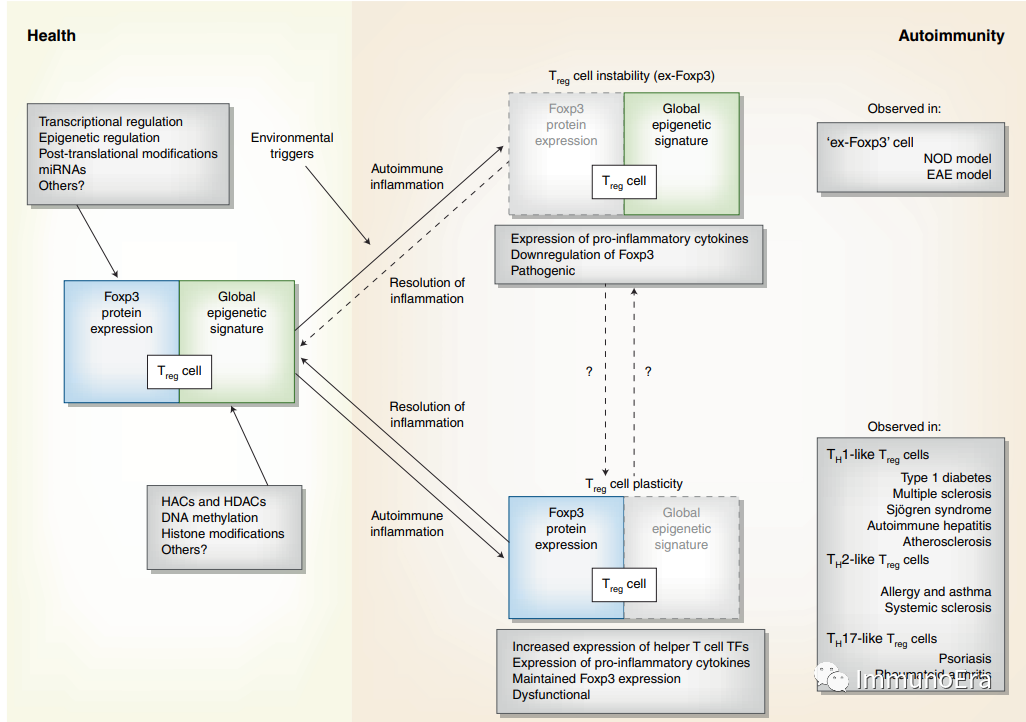
Treg细胞功能程序依赖于以下两个主要轴(Foxp3表达和一个全局表观遗传特征),这两个轴都受到各种因素的调节,并在健康条件下保持。
在基因易感人群中,环境触发器诱发炎症,一部分Treg细胞会失去Foxp3表达并变得不稳定(Treg细胞不稳定;ex-Foxp3);或可维持Foxp3表达,但改变其整体表观遗传特征(Treg细胞可塑性),分泌促炎细胞因子并显示功能降低。
Treg细胞的不稳定导致了所谓的“ex-Foxp3细胞”,这已经在糖尿病(NOD)和多发性硬化症(EAE)的小鼠模型中被观察到。
Treg细胞的可塑性导致Treg细胞获得th1样、th2样或th17样的特性;这些结果都已在小鼠和人类的各种自身免疫性疾病中被观察到。虽然Treg细胞不稳定性和Treg细胞可塑性之间的机制联系尚不清楚,但可塑Treg细胞在炎症消退后可以成为“正常的”Treg细胞。
肠屏障功能障碍
在CVID不一致的同卵双胞胎中,相同的基因型导致显着不同的临床表型,暗示环境因素起着重要作用。现有研究认为微生物组在IEI和IMID免疫功能障碍中起着重要作用,将肠道屏障功能障碍和微生物产物的免疫激活与非感染性并发症的发展联系起来。
多组学已被用于重新审视CVID患者非感染性并发症的生物标志物。可溶性CD14是单核细胞活化的标志物,在有并发症的患者中增加,并且与细胞因子升高,血清IgA水平降低有关,特别是与脂多糖结合的IgA和IgM抗体水平较低。前3个贡献因素是高CXCL10(一种由IFN-g诱导的趋化因子)、低抗体(总同种型和LPS特异性)和低同种型切换记忆B细胞,与体液免疫缺陷(尤其是IgA)导致屏障功能障碍、细菌易位、免疫系统先天和适应性激活以及组织浸润和/或自身免疫的模型一致。
在IMID患者中也有肠屏障功能障碍的报道,靶向肠道屏障破坏可以治疗全身炎症。
EBV病毒
EB病毒感染(EBV)对发生SLE和多发性硬化症的风险有深远的影响。研究显示,EBV让多发性硬化症的风险增加了32倍,被认为是“多发性硬化症的主要原因”。
类似的研究发现,EBV感染显著增加了SLE的风险:早期文章,来自美国数据显示风险增加了50倍,后来来自亚洲数据显示风险增加了29倍。
可能原因是EBV抗原和自身抗原之间的交叉反应性。例如,EBV核抗原与SLE患者的Sm和DNA,与多发性硬化症患者的髓鞘碱性蛋白(MBP)发生交叉反应
后续还发现EBV可以通过扩增自身反应性ABCs来促进自身免疫。
HLHMAS
继发性噬血细胞性淋巴组织细胞增多症(hemophagocyticlymphohistiocytosis,HLH)和巨噬细胞活化综合征(macrophageactivationsyndrome,MAS)是系统性炎症性疾病的潜在危及生命的并发症,最常见于系统性幼年特发性关节炎(sJIA)和系统性红斑狼疮(SLE)。
*噬血细胞性淋巴组织细胞增多症(HLH)又称为噬血细胞综合征(HPS),是一种遗传性或获得性免疫调节功能异常导致的严重炎症反应综合征。
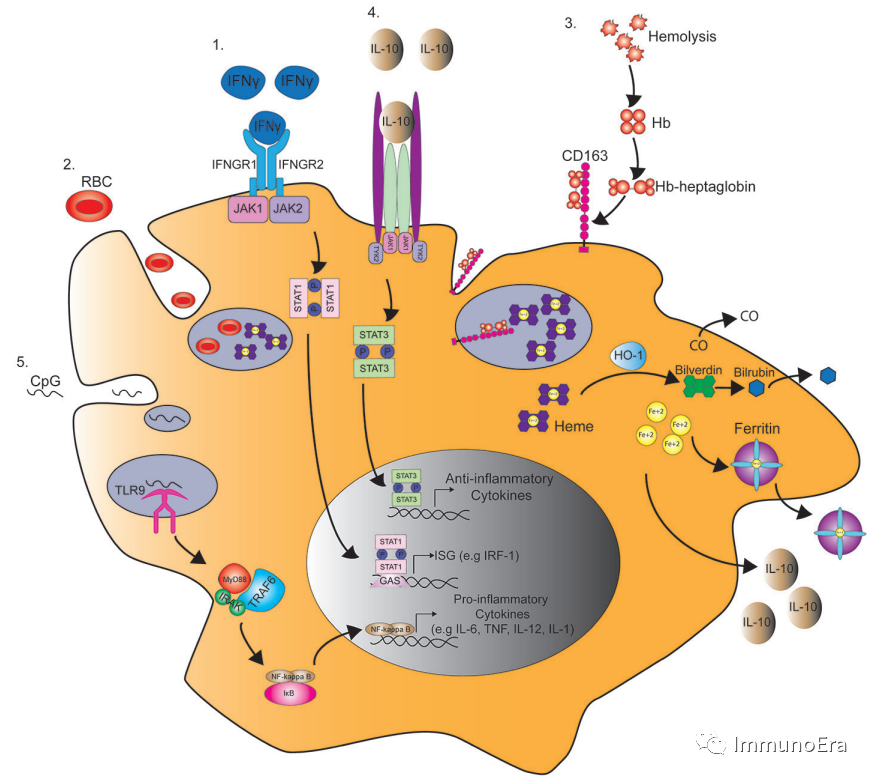
MAS的临床和实验室特征包括持续发热、高铁蛋白血症、全血细胞减少、纤溶性凝血功能障碍和肝功能障碍。可溶性CD25(sCD25)和sCD163可能升高,组织病理学常显示骨髓(和其他组织)中噬血细胞活性增加,CD163染色阳性。
关于MAS的一个常见假说是淋巴细胞溶解活性的缺陷。家族性HLH相关的溶细胞途径基因(如PRF1、UNC13D)中的特异性杂合子基因突变与大量的MAS患者有关。
此外,促炎细胞因子环境,特别是IL-6,已被证明会降低NK细胞的细胞溶解功能。
NK细胞和溶细胞性CD8T细胞不能溶解受感染的和以其他方式激活的抗原提呈细胞,导致细胞间(先天免疫细胞和适应性免疫细胞)的相互作用延长和促炎细胞因子级联反应的扩增。
细胞因子风暴导致巨噬细胞的激活,引起噬血细胞作用,并导致多器官功能障碍。
MAS调控通路()
除了巨噬细胞外,树突状细胞可能在溶细胞淋巴细胞的抗原呈递中发挥关键作用,并促进细胞因子的表达。一些细胞因子,包括TNF、IFN和大量的白细胞介素(即IL-1、IL-6、IL-18、IL-33),都与细胞因子级联反应有关。除了广泛的免疫抑制疗法,新的细胞因子靶向治疗正在被探索,以抑制过度活跃的免疫反应。
儿童多系统炎症综合征
尽管大多数感染2019年冠状病毒病(COVID-19)的儿童表现良好,但一小部分儿童会出现称为儿童多系统炎症综合征(MIS-C)的超炎症反应。超级抗原可能在这种疾病中起重要作用。
参考文献
HaoY,O’NeillP,NaradikianMS,ScholzJL,:1294–304
RubtsovAV,RubtsovaK,FischerA,MeehanRT,GillisJZ,(TLR7)-drivenaccumulationofanovelCD11c+:1305–15
‑associatedBcellsinautoimmunediseases,CellularandMolecularLifeSciences(2022)79:402
ZhaoTV,SatoY,GoronzyJJandWeyandCM(2022):867950.doi:10.3389/
,;19(7):665-673
CrayneCB,AlbeituniS,NicholsKEandCronRQ(2019):119.doi:10.3389/
-
梁静茹张韶涵杨宗纬演唱会 点燃威海星空
2025-07-09 -
荣耀 V40 评测:「承上启下」之作,有传承也有创新
2025-03-16 -
预算100个,哪一款MPV才是商用的首选?
2025-11-19 -
气动减震智能调节,传祺M8改装HF风格诠释旗舰MPV魅力
2026-01-11